臨床轉化藥物安全性評價服務價格
無論是面向期刊發表還是產品注冊,毒性研究報告的結構與表述方式都需滿足規范要求。潮新生物的毒性實驗報告由專人撰寫與復核,內容包含實驗背景、設計方法、觀察指標、結果統計、討論與結論等完整模塊,附帶原始數據、圖片記錄與分析圖表,便于后續查閱與引用。報告格式可根據客戶目標調整,例如符合《中國非臨床研究質量管理規范》格式,或參照ICH、OECD等國際指南標準,滿足境內外不同用途的應用場景。我們還提供PDF與Word雙版本交付,并可根據項目需要進行英文化輸出,便于國際合作或申報使用。每一組實驗動物都經過健康篩查與標準飼養,確保模型質量可控穩定。臨床轉化藥物安全性評價服務價格
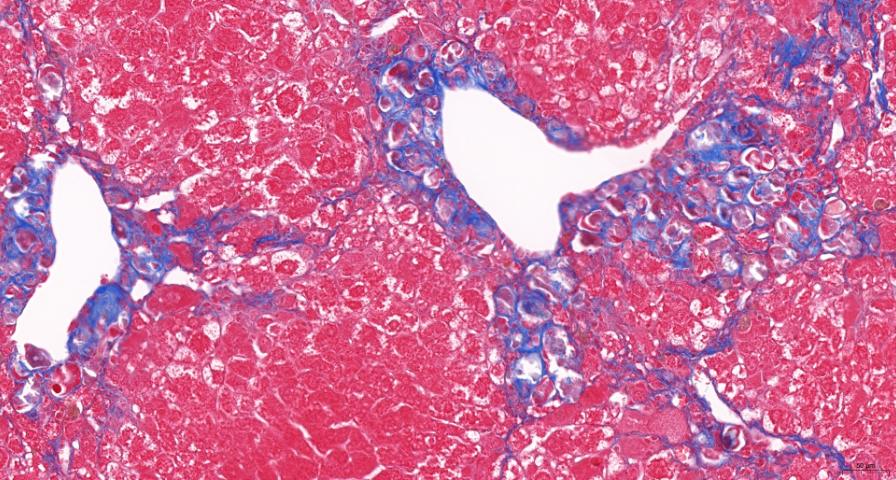
關注特殊人群的安全邊界兒童藥物研發面臨特殊的挑戰,其生理特征、代謝能力、器、官發育狀態均不同于成人,因此安全性評估必須充分考慮這些差異。潮新生物在兒童用藥相關毒性研究中采用貼近目標人群的實驗設計策略,包括發育階段匹配的小動物模型、特殊劑型處理、行為觀察指標強化等。我們提供生殖毒性、發育毒性、神經行為毒性等系統測試服務,并關注長期給藥對成長指標的影響。通過科學的實驗路徑與針對性評估手段,協助客戶為兒童藥物研發構建更穩妥的安全數據體系,滿足監管對特殊人群研究的嚴謹要求。藥物篩選藥物安全性評價價格表專業技術團隊負責數據解讀,幫助客戶準確判斷毒性反應的實際意義。

靈活適配、穩妥推進近年來,全球醫藥監管體系不斷改、革,對非臨床研究質量和透明度的要求持續提升。潮新生物緊跟政策變化,定期研讀NMPA、FDA、EMA等機構發布的指南、通告和行業意見稿,及時更新實驗設計模板與報告結構,確保服務始終處于合規軌道。我們可為客戶提供法規咨詢、路徑分析與風險預警,協助研發團隊理解監管要點,規避因規范變化帶來的重復試驗或延遲申報問題。尤其在數據完整性、GLP理念采納、電子記錄溯源等環節,我們已提前構建相應體系,為客戶快速響應政策變化提供有力支持。
潮新生物在服務過程中重視客、戶數據的保密與知識產權保護,所有毒性實驗資料、報告內容及原始記錄均在合同協議框架內進行嚴格管理。我們設有獨、立數據存儲系統,對每一個項目設定權限訪問機制,確保未經授權的數據不會被調閱或外泄。實驗原始數據可保存三年,支持客戶進行歷史記錄追溯、補充分析或成果驗證。針對具有技術敏感性的課題或尚處專利申請前階段的項目,我們也可提供額外的保密協議支持,限度保障客戶在研發過程中的技術安全,助力其在商業化推進中具備更穩定的法律基礎。每一項毒性評估,都為新藥研發構筑更堅實的數據基礎,助力項目順利推進。
潮新生物積極構建行業交流平臺,定期舉辦有關藥物非臨床研究與毒性評價的培訓班、專題沙龍與線上公開課,邀請行業從業者、科研人員及監管專、家共同參與。通過分享前沿的監管動態、研究方法、案例分析與常見問題處理策略,我們希望為客戶提供一個知識更新、經驗積累、問題互解的專業網絡環境。參與者不僅可以了解潮新生物的服務能力與實驗實踐,也有機會就自身項目的具體問題與團隊進行現場交流與定向咨詢,形成真正以客戶研究為中心的技術服務共同體。對于多批次對比研究,我們可支持分組數據統一呈現,便于趨勢分析。規范化流程藥物安全性評價選擇
我們注重實驗的每一個細節,只為輸出真實、可溯源、科學可靠的研究結果。臨床轉化藥物安全性評價服務價格
支持創新藥孵化項目的毒性研究策略制定在創新藥物從實驗室走向產業化的早期階段,毒性研究不僅是數據積累的過程,更是篩選方向、控制風險、獲取資本支持的重要環節。潮新生物深度參與多個創新藥孵化項目,熟悉從種子分子篩選到候選物確立的全流程需求。我們根據客戶目標提供分階段毒性研究建議,協助搭建初步安全性數據庫、優化結構方向、規劃關鍵試驗路徑,尤其適用于高校技術轉化、初創企業立項、項目孵化器平臺。通過與客戶密切協作,我們幫助研發者在起步階段就建立清晰、可控、合規的開發路線,為后續融資、申報與合作打下堅實基礎。臨床轉化藥物安全性評價服務價格
- 臨床前研究生物外包公司售后說明 2025-07-13
- 神經系統藥物安全性評價單價 2025-07-13
- MCAO模型神經系統與精神類模型 2025-07-13
- 實惠動物模型造模優惠價 2025-07-13
- 實驗技術轉移生物外包公司服務清單 2025-07-13
- RNA測序生物外包公司服務入口 2025-07-13
- 腦干HE染色在線咨詢 2025-07-13
- 組織圖譜生成動物實驗病理染色獲取報價 2025-07-13
- 南京慢性社會挫敗應激模型(CSDS)神經系統與精神類模型多少錢 2025-07-13
- 靠譜的藥物安全性評價報價單 2025-07-13
- 天津填埋場相關檢測與評估咨詢熱線 2025-07-13
- 青浦區什么是企業管理咨詢 2025-07-13
- 廣安冷鏈物流凍庫費用 2025-07-13
- F316下屈服強度試驗 2025-07-13
- 臨時辦公室租賃信息 2025-07-13
- 黃山HIGG/FEM認證基本知識 2025-07-13
- 中國香港綠色學校節能評估政策 2025-07-13
- 南京常規電子電器產品檢測服務電話 2025-07-13
- 孩子叛逆期家長怎么辦 2025-07-13
- 市場公關服務公司 2025-07-13