四川X射線-熒光X射線-熒光雙模態成像系統量大從優
骨微結構與分子互作:高分辨雙模態解析系統的X射線顯微成像(5μm分辨率)可清晰顯示骨小梁的連接度(Conn.D)與厚度(Tb.Th),而熒光顯微模塊(1μm分辨率)能標記破骨細胞(TRAP探針)的活性位點。在骨質疏松模型中,雙模態成像發現骨小梁斷裂處的破骨細胞熒光強度較完整區域高2.3倍,且X射線所示的骨密度下降與熒光標記的RANKL表達呈正相關(r=0.87),這種“結構-分子”的關聯分析為抗骨吸收藥物研發提供直接靶點證據。在骨創傷修復中,系統通過X射線評估骨折愈合進程,熒光標記血管內皮生長因子表達。雙模態系統在骨轉移研究中通過X射線識別溶骨病灶,熒光標記腫瘤細胞活性。四川X射線-熒光X射線-熒光雙模態成像系統量大從優

自適應劑量調節:輻射安全與成像效率的平衡雙模態系統的智能劑量算法可根據樣本厚度自動調節X射線參數(10-50kV),在小鼠全身骨成像中將單次輻射劑量控制在0.5mGy以下(相當于胸部CT的1/10),同時通過近紅外二區熒光(1000-1700nm)提升分子信號的信噪比(達8:1)。在長期縱向研究中,該技術可實現每周2次的重復掃描,追蹤骨轉移*的進展與***響應,較傳統高劑量X射線方案減少動物輻射損傷風險達70%。雙模態系統的輻射防護鉛艙設計,將操作人員暴露劑量控制在安全閾值以下。黑龍江成像系統X射線-熒光雙模態成像系統品牌排行高速雙模態采集(20幀/秒)可記錄骨折瞬間的骨微損傷與血小板活化的熒光信號響應。

雙模態影像融合精度:解剖與分子的亞微米級配準系統采用基于特征點的配準算法,將X射線與熒光影像的空間偏差控制在2μm以內,確保骨小梁結構與熒光標記細胞的精細對應。在骨轉移*研究中,該精度可識別單個破骨細胞(直徑15μm)與骨小梁微損傷(長度50μm)的空間關系,發現破骨細胞與損傷位點的平均距離<5μm,為“細胞-骨”互作的機制研究提供亞細胞級證據,較傳統配準方法(偏差10μm)更精細揭示分子作用位點。雙模態影像的配準精度達2μm,確保X射線骨結構與熒光標記細胞的空間位置一致性。
AI輔助診斷:雙模態數據的智能分析內置的卷積神經網絡模型可自動檢測X射線中的骨結構異常(如溶骨、成骨病灶),并關聯熒光通道的分子標記強度。在骨轉移*篩查中,AI算法對X射線病灶的檢出靈敏度達98%,且能根據熒光信號強度預測腫塊惡性程度(與病理分級的一致性達91%)。該功能將傳統需要4小時的影像分析縮短至20分鐘,尤其適合大規模隊列研究中的骨疾病早期篩查。實時圖像融合算法讓X射線—熒光成像系統在骨科微創手術中同步顯示骨結構與腫塊邊界。X射線—熒光雙模態成像系統的多參數分析模塊,量化骨體積分數與熒光信號強度的相關性。
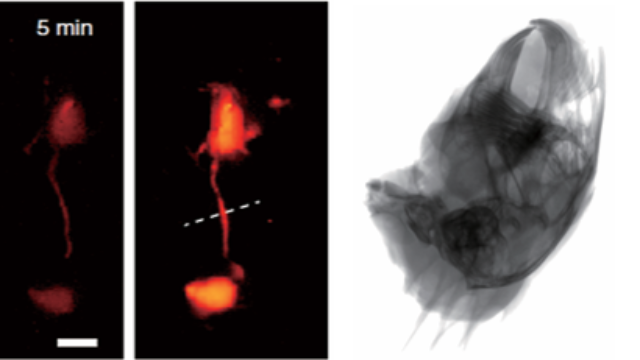
雙模態光譜分析:骨骼成分與分子探針的同步檢測系統的X射線熒光光譜(XRF)功能可分析骨礦物質成分(如Ca/P比),同時近紅外熒光通道檢測探針信號,在骨礦化障礙疾病中實現“成分-分子”聯合分析。在佝僂病模型中,XRF顯示骨Ca/P比從1.67降至1.42,熒光標記的維生素D受體表達下降35%,兩者的相關性達0.89,為疾病機制研究提供化學組成與分子調控的雙重證據,較單一檢測手段更多元化揭示病理本質。雙模態探頭的模塊化設計支持靈活切換X射線分辨率(5-50μm)與熒光檢測靈敏度。實時圖像融合算法讓X射線—熒光成像系統在骨科微創手術中同步顯示骨結構與腫塊邊界。黑龍江成像系統X射線-熒光雙模態成像系統品牌排行
該系統在骨再生醫學中通過X射線監測植入物骨整合,熒光標記干細胞分化軌跡。四川X射線-熒光X射線-熒光雙模態成像系統量大從優
跨模態參數關聯分析:從影像到機制的深度挖掘系統的數據分析模塊可自動計算X射線參數(如骨小梁分離度Tb.Sp)與熒光指標(如凋亡細胞熒光強度)的相關性,在骨質疏松性骨折模型中發現Tb.Sp與成骨細胞凋亡率的相關系數r=0.85。這種跨模態關聯分析可深入挖掘影像數據背后的生物學機制,例如通過X射線的骨微結構異常預測熒光標記的細胞凋亡通路***,為骨疾病的早期預警與干預提供分子層面的理論依據。 X射線—熒光雙模態成像系統的無線數據傳輸功能,支持手術間與實驗室的實時影像共享。四川X射線-熒光X射線-熒光雙模態成像系統量大從優
- 上海數聯近紅外二區稀土探針價格對比 2025-07-25
- 天津試劑近紅外二區稀土探針聯系方式 2025-07-25
- 廣西全光譜近紅外二區顯微成像系統廠家直銷 2025-07-25
- 全光譜近紅外二區稀土探針客服電話 2025-07-25
- 中國澳門小動物近紅外二區顯微成像系統代加工 2025-07-25
- 陜西近紅外二區熒光壽命成像系統市場報價 2025-07-25
- 廣東X射線-熒光近紅外二區顯微成像系統維保 2025-07-25
- 北京近紅外二區熒光壽命成像系統采購信息 2025-07-25
- 西藏小動物近紅外二區熒光寬場成像系統哪家好 2025-07-25
- 新疆X射線-熒光近紅外二區稀土探針技術參數 2025-07-24
- 材料力學測試拉力機生產廠家 2025-07-25
- 黃浦區品牌儀器儀表維保 2025-07-25
- 惠山區怎樣沼氣流量計調試 2025-07-25
- 廣東自費場鏡 2025-07-25
- 車輛實時調度綜合管理平臺調度管理系統費用 2025-07-25
- 廣東亞微米級雙光子聚合微納加工系統 2025-07-25
- 紹興多功能大氣污染物監測儀報價 2025-07-25
- 高頻局部放電電量數值 2025-07-25
- 北京金色介質增強銀反射鏡作用 2025-07-25
- 蘇州金屬粒子檢測儀器廠家 2025-07-25