河南研究菌群移植適用人群
在根特大學的雙盲試驗中,接受健康供體FMT的患者運動功能改善。“他們動作更敏捷,僵硬感減輕,穿衣吃飯不再費力。”根特大學神經學家Patrick Santens描述道。令人意外的是,連安慰劑組(移植自身菌群)也有2.7分的提升,暗示腸道環境本身對癥狀存在復雜調控。目前,Santens團隊正分析供體菌群特征,試圖鎖定“關鍵菌種”,并計劃于2026年啟動更大規模試驗。
未來療法:精細干預還是阻斷機制?科學家們正從兩條路徑推進研究:一是通過膳食纖維補充、FMT等手段重塑菌群平衡;二是針對微生物群觸發的病理機制開發靶向藥物。例如,加州大學團隊發現,大腸桿菌在炎癥環境中會氧化多巴胺,促使α-突觸**白聚集,而咖啡酸可阻斷這一過程;另一團隊則從綠茶提取物中找到了抑制致病蛋白“Curli”的方法,相關藥物已進入研發階段。盡管前景光明,謎團依然存在。帕金森病可能存在“腸道優先”和“大腦優先”兩種亞型,而菌群干預對哪類患者更有效?長期追蹤數據仍匱乏。美國NIH資助的“腸腦軸”研究聯盟正試圖填補這一空白,計劃對患者菌群變化進行多年跟蹤。 菌群移植研究揭示,微生物群落失衡與多種慢性病有關聯。河南研究菌群移植適用人群
菌群移植應建立不良反應及處理流程:1.建立不良反應上報制度(2C)2.執行嚴格的入選和排除標準,FMT診療前評估并發癥風險(1C):(1)誤吸風險,如高齡、臥床、賁門關閉不全等高風險者禁用鼻腸管途徑,給予口服膠囊或結腸鏡FMT途徑;(2)腸源性風險,如全身及腸黏膜屏障功能嚴重受損應禁用FMT診療(1C)3.癥狀輕(以頭暈、惡心、胃腸道不適等為主訴)的患者,觀察即可(1C)4.中度癥狀對癥處理,不能緩解予以暫停FMT診療(2D)5.癥狀嚴重(由鼻腸管途徑導致的咽喉部疼痛、惡心、嘔吐等)者,對癥處理不能緩解,給予拔除鼻腸管,改口服膠囊、結腸鏡或灌腸移植途徑(2D)6.癥狀嚴重者,暫停或終止FMT診療并對癥處理;體溫≥39℃者需排除腸源性***(2D)7.懷疑腸源性癥狀時,立即終止FMT診療,檢測供體和受體糞便致病菌,留取血培養檢查,補液等診療(1C)8.極重度癥狀如并發生命體征異常者,立即終止FMT診療,同時針對靶診療(1C)!重慶腸道菌群移植的效果腸道菌群移植在代謝性脂肪性肝病中的應用。
本研究通過小鼠模型揭示了人類炎癥性腸病(IBD)患者的腸道微生物群移植(FMT)效率是實驗變異性的一個重要來源,而適應于小鼠環境的人類IBD患者腸道微生物群則能高效穩定地轉移,導致更為一致和可重復的結腸炎表型;2直接從人類轉移到小鼠的FMT導致了微生物群組成的高度個體間變異,而經過小鼠適應的FMT則顯示出低變異性和高一致性;3小鼠適應過程中的炎癥環境塑造了更具攻擊性的微生物群,這在連續移植到IL-10基因敲除小鼠中引起了更嚴重的結腸炎;4以上發現支持一種IBD發病機制模型,即宿主炎癥促進了具有攻擊性的常駐細菌的擴張,進而加劇了由腸道炎癥引起的菌群失調;5本研究結果提示,優化的小鼠適應人類微生物群模型可以作為研究人類微生物群驅動的疾病表型的有力工具。
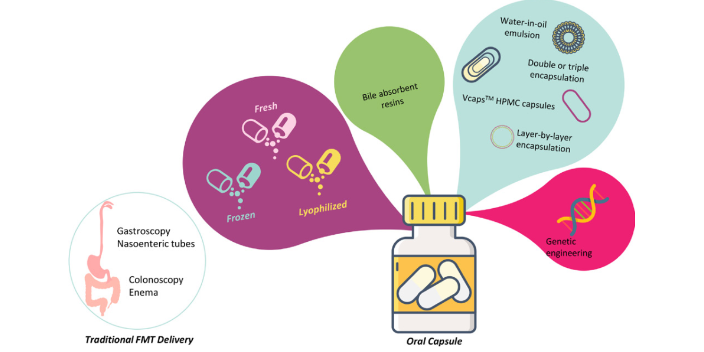
精細化菌群移植的流程包括供體的篩選,菌群的分離提取(沃本生物有自主知識產群的菌群分離儀,并已完成生產菌群的分離提取,這是菌群移植2.0時代的標志),菌群庫的建設,供受體配型(供受體配型是菌群移植3.0時代的標志),然后是移植方式的選擇。移植途徑的建立是FMT實施的重要環節,狹義的移植途徑是指將功能菌群通過某種路徑傳遞入患者腸道內,具體包括上消化道路徑與下消化道路徑;廣義的移植途徑是指為了順利將功能菌群傳遞入患者腸道、并盡可能使其有效性和安全性比較大化而采取的一系列措施,包括移植前準備、移植路徑的建立和圍移植期監測與護理。菌群移植前需進行嚴格篩選與匹配,確保移植菌群的安全性與有效性。

香港中文大學的團隊發表研究,表明糞菌移植(FMT)可能是一種有效且安全的應用在急性后COVID-19綜合征(PACS)導致睡眠障礙的方法;2招募60名患有睡眠不好的PACS患者,隨機接受FMT或者對照應用在,接受FMT的患者在12周后睡眠不好緩解率明顯高于對照組(37.9% vs 10.0%);3從基線到第12周,從基線到第12周,FMT組患者的睡眠不好嚴重指數(ISI)、匹茲堡睡眠質量指數(PSQI)、***性焦慮障礙-7量表(GAD-7)、埃普沃思嗜睡量表(ESS)、血液皮質醇均有所下降,但在對照組中沒有明顯變化;4FMT后,有益細菌如Gemmiger formicilis增加,而產生甲萘醌衍生物的微生物途徑減少,這些變化與臨床癥狀的改善相關;5在第12周時,FMT應答者的腸道微生物群譜與供體相似,而非應答者則不相似,沒有發生嚴重的不良事件。菌群移植技術正逐步應用于難治性疾病,為患者帶來新希望!上海醫院菌群移植**共識
STING蛋白如何助力糞菌移植改善IBD?河南研究菌群移植適用人群
鄭州大學第二附屬醫院團隊揭示了干擾素基因刺激因子(STING)在糞菌移植(FMT)應用小鼠潰瘍性結腸炎中的關鍵作用,發現STING依賴方式可改善炎癥性腸病患者的免疫失衡狀態。2通過比較不同STING表達水平的小鼠在接受FMT應用后的效果差異,發現FMT療法以STING依賴的方式緩解DSS誘發的結腸炎;3機制上,FMT通過STING調控腸道Th17細胞和巨噬細胞、脾臟Th1和Th2細胞以及腸系膜淋巴結Th1細胞的分化,下調結腸M1/M2和脾臟Th1/Th2細胞比例,從而緩解癥腸炎的免疫失衡狀態;4同時,STING可促進供體菌株尤其是乳酸菌屬在受體腸道中的定植,從而重塑結腸炎中失調的腸道菌群;5本研究表明STING作為FMT應用的關鍵靶點,或可成為篩選適合接受FMT應用個體的生物標志物,以優化應用方案并提高臨床益處。河南研究菌群移植適用人群
- 福建腸道菌群移植多久見效 2025-06-10
- 安徽常見菌群移植費用 2025-06-10
- 山西醫院菌群移植儀器 2025-06-10
- 河南直腸菌群移植療效 2025-06-10
- 陜西腸道菌群移植要多少錢 2025-06-10
- 甘肅腸道菌群移植是什么意思 2025-06-10
- 山西供體菌群移植成功案例 2025-06-10
- 河南自體菌群移植費用 2025-06-10
- 安徽腸道菌群移植成功案例 2025-06-10
- 江西腸道菌群移植痛苦嗎 2025-06-10
- 福建腸道菌群移植多久見效 2025-06-10
- 神經退行性疾病蛋白標志物廠家 2025-06-10
- 膠原蛋白肽固體飲料肽特殊膳食 2025-06-10
- 貴州法醫刑事勘察采集卡血液卡 2025-06-10
- 陜西二類口腔拭子哪家好 2025-06-10
- 廣州醫療艙廠家 2025-06-10
- 上海質量中鹽核酸酶價格表 2025-06-10
- 寶山區分子耗材廠家電話 2025-06-10
- 人體足底壓力廠家電話 2025-06-10
- 廣州一次性CGT配件耗材一站式生產制造 2025-06-10