山西國內高鹽核酸酶量大優惠
目前基因藥物領域常用的病毒載體有腺病毒、慢病毒、重組腺相關病毒(rAAV)以及逆轉錄病du等,其中AAV因其免疫原性極低、安全性高、宿主細胞范圍廣、擴散能力強、表達穩定以及特異性強等優勢脫穎而出。據NIH統計,已有超過200個正在進行或已完成的基因藥物臨床試驗使用rAAV載體。盡管rAAV基因藥物已顯示出巨大的前景,但是強大、穩健而且可放大的基因載體生產制造工藝一直是CGT行業的痛點。目前rAAV生產平臺主要有三種:三質粒瞬轉體系(TransientTransfection, TT)、桿狀病毒表達載體體系(Baculovirusexpression vector,BEV)和包裝細胞體系(Packaging/Producercell line,PCL)。GMP級別SAN HQ提供了更多的監管保證。山西國內高鹽核酸酶量大優惠
宿主細胞DNA殘留的擔憂是基于致ai風險理論,特別是生產細胞系所包含的致ai序列,比如較常見腺病毒基因E1A和E1B(HEK293, PerC.6 和CAP 細胞系),人乳tou瘤病毒E6和E7基因(HeLa細胞系)等。當使用致ai細胞系生產AAV時,下游純化須盡可能減少殘留DNA。工業上一般使用核酸酶分解殘留DNA,普遍認為小于200 bp的DNA片段可有效降低致ai風險。宿主細胞蛋白殘留與免疫原性、炎癥或過敏性休克有關。盡管與非人類的生產原料相比(非人類細胞系如BHK21或昆蟲細胞,以及輔助病毒如HSV、腺病毒、桿狀病毒),人類細胞免疫原性比較弱。河北效果高鹽核酸酶哪家公司銷售江蘇高鹽核酸酶款式哪家好呢,歡迎咨詢上海倍篤生物 。
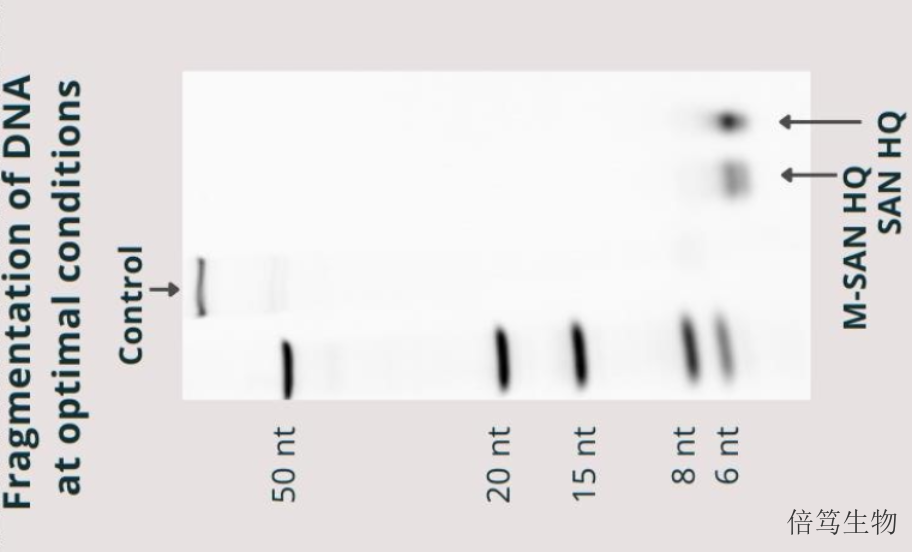
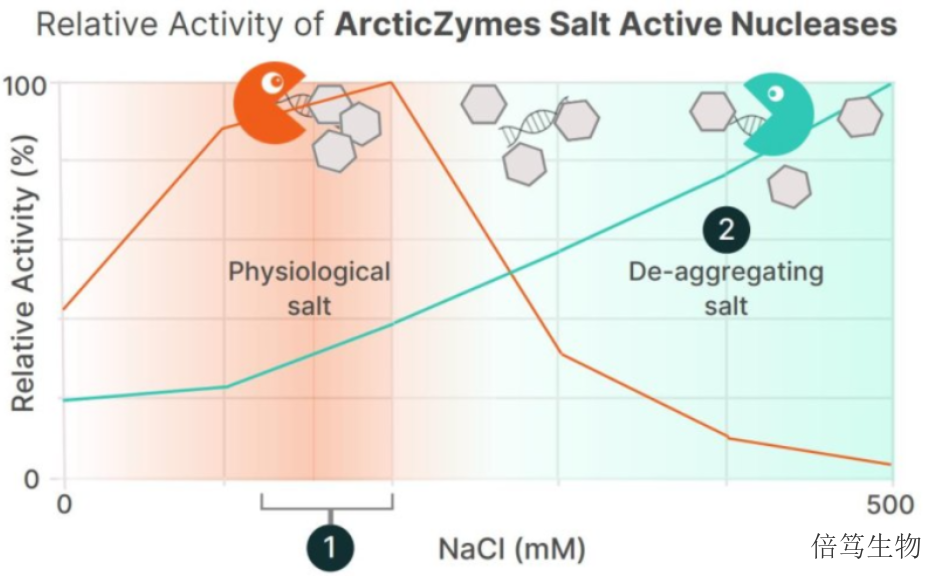
ArcticZymes廠家對鹽活性核酸酶系列產品(Salt Active Nucleases,SANs)的生產及質控,在符合ISO13485:2016體系基礎上,增加了cGMP質控標準,如microbes、endotoxin、蛋白酶等,符合USP-EP要求。廠家提供HQ級別和GMP級別的SAN HQ高鹽核酸酶和M-SAN HQ中鹽核酸酶,從成本角度分別滿足臨床前和早期臨床階段、商業化大規模生產階段的需求;且GMP級SAN HQ高鹽核酸酶已完成在FDA的藥物主文件(Drug Master File, DMF)申報備案,助力加快藥物申報流程。
從國內來看,由于 AAV 基因藥物研發管線絕大部分集中在眼科遺傳病上,載體用量較小,三質粒共轉染 AAV 系統足以滿足未來的臨床及商業需求,因此,國內的 AAV 生產系統主要以三質粒為主。然而,考慮到未來 AAV 基因藥物在血液、神經系統、肌肉系統等領域的臨床應用,三質粒系統顯然難以勝任。如藥明生基從國外收購了 OXGENE 的輔助腺病毒 AAV 生產系統 TESSA,據報道較三質粒系統有10倍的提升;而基因藥物 CDMO 企業北京五加和基因則在國內率先采用了陳海峰博士的威洛克公司授權的Bac-to-AAV 系統,憑借公司在病毒載體領域持續30年的研發經驗,不斷摸索、試驗,終于在臨床級生產方面獲得了巨大的成功,為 AAV 基因藥物管線研發公司錦籃基因進行多批次臨床 CDMO 代工生產。浙江高鹽核酸酶價格哪家好呢,歡迎咨詢上海倍篤生物 。

有研究發現,桿狀病毒表達載體體系BEV生產的rAAV發生了與293生產體系不同的衣殼蛋白翻譯后修飾(post-translationalmodifications,PTMs)。這一差異是否會影響載體趨向性和轉導效率還需要進一步驗證。除此之外,桿狀病毒多重infection會導致載體蛋白VP1、VP2和VP3比例不一致。盡管如此,BEV/Sf9系統仍然是一種頗有吸引力的大規模臨床級載體生產策略。隨著以后對基因藥物需求的增加,AAV載體的需求量也會與日俱增,而BEV系統能夠降低AAV的成本,未來還是很有發展潛力的。SAN HQ高鹽核酸酶有助于減少了宿主細胞殘留DNA的污染,提高了基因藥物的安全性。宿遷70921-160高鹽核酸酶采購
南京高鹽核酸酶售后服務哪家好呢,歡迎咨詢上海倍篤生物 。山西國內高鹽核酸酶量大優惠
基因藥物是指將外源基因引入靶細胞,糾正或補償基因缺陷或異常引起的疾病的。這種策略對許多疾病的康復有很大的潛力,包括ai癥、神經退行性疾病和心血管疾病。目前已經進行了2000多項基因藥物臨床試驗,大多數載體已被證明是有效和安全的。目前的研究表明,大約64%的基因藥物臨床試驗是為了醫治ai癥疾病,而最常見的策略是傳遞抑制cancer生長或殺死cancer的基因。基因藥物的關鍵是使用安全有效的基因傳遞載體,如病毒載體和非病毒載體。病毒載體是常用的基因導入的方式之一。而腺病毒的載體由于轉基因效率高,不受靶細胞是否分裂的限制,容易制備高滴度的病毒載體,在基因藥物和免疫領域有更多的應用。山西國內高鹽核酸酶量大優惠
- 福建M-SAN HQ中鹽核酸酶價格 2025-08-01
- 國內高鹽核酸酶量大優惠 2025-08-01
- 青海中鹽核酸酶聯系方式 2025-08-01
- 山東70921-202高鹽核酸酶價格 2025-08-01
- 山東國內高鹽核酸酶價格 2025-08-01
- 山西進口高鹽核酸酶用途 2025-08-01
- 湖南70950-160高鹽核酸酶聯系方式 2025-07-31
- 福建70950-202高鹽核酸酶銷售電話 2025-07-31
- 山西70921-160高鹽核酸酶哪家公司銷售 2025-07-31
- 山東智能高鹽核酸酶價格 2025-07-31
- 廣州奧托博克1C58Taleo踏躍萬向踝版 2025-08-01
- 溫州全自動分杯工作站 2025-08-01
- 上海摘除眼球保留義眼沒有分泌物 2025-08-01
- 四川植物冠層光合氣體交換測量系統一體化 2025-08-01
- 西南丁香酚水門汀價格 2025-08-01
- 深圳智能穿戴IVD醫療器械定制研發生產服務商 2025-08-01
- 坐躺兩用微高壓氧艙氧氣濃度是多少 2025-08-01
- 虹口區標準工業自動化系統集成規劃 2025-08-01
- 青浦區環保切片 2025-08-01
- 浦東新區智能儀器儀表專賣店 2025-08-01