寧波外泌體提取試劑單價
具膜囊泡,當我們使用常規方法分離這些結構時不推薦使用其他的名稱來稱呼它們。外泌體(exosome)適用于通過特殊手段拿到的由胞內體來源的釋放到細胞外的膜泡結構。建議對細胞外囊泡進行細分時使用物理上的界定如小細胞外囊泡(sEV)和中/大細胞外囊泡(m/lEV),或者高密度囊泡(highdensity)和低密度囊泡(lowdensity)等,同時也建議使用表面蛋白來界定如CD63+CD81+細胞外囊泡等。當使用exosomes等稱呼時應當進行嚴謹的實驗證明使用的“exosomes樣品”是由胞內體途徑產生的。小和同學:都是細胞外囊泡,外泌體和微囊泡有啥區別?小光老師:外泌體和微囊泡的區別在于其生成的方式不同。從晚期內體來源產生的細胞外囊泡稱為外泌體,從細胞膜直接出芽產生的細胞外囊泡稱為微囊泡。用于外泌體提取的體液收集注意事項:注意抗凝劑的選擇。寧波外泌體提取試劑單價
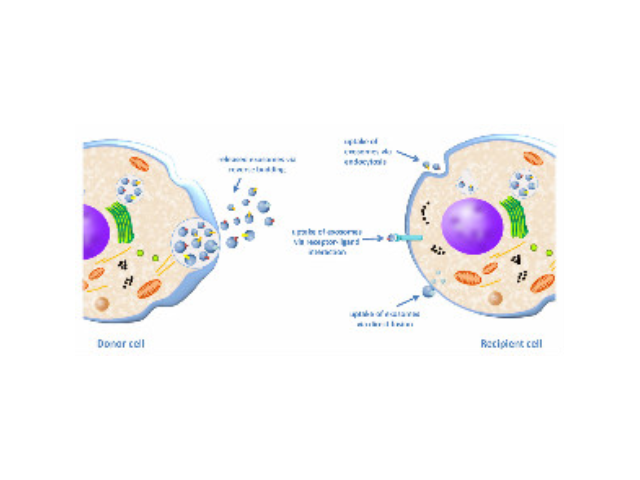
外泌體的提取方法學規范、統一定量及鑒定等。關于外泌體的提取有超速離心、試劑盒、超濾法、蔗糖密度梯度離心等,然而各種方法均有其利弊。超速離心法是目前外泌體相關文章中的主流方法,由于離心步驟繁瑣,費事費力,而且步驟多導致實驗中容易污染,且損耗量大,使得較終回收的外泌體不穩定。而且對于抽提細胞上清來說,更是極為不請便,試想用提取300ml的上清需要6個50ml離心管,無論是過濾還是后續的每一步的離心去沉淀,都具有操作極其不便的缺點,總之非常麻煩。而超濾法存在外泌體會堵塞膜孔,造成濃縮效率低,濃縮管重復利用差,甚至堵塞在膜孔的外泌體還可能會粘連成團,造成損失及較后的數據有誤差,對于后續實驗也有影響。石家莊外泌體提取試劑廠家現貨如純度和回收率低,雜蛋白較多(假陽性),顆粒大小不均一,產生難以去除的聚合物。
外泌體的提取方法:1、色譜法。色譜法是利用根據凝膠孔隙的孔徑大小與樣品分子尺寸的相對關系而對溶質進行分離的分析的方法。樣品中大分子不能進入凝膠孔,只能沿多孔凝膠粒子之間的空隙通過色譜柱,首先被流動相洗脫出來;小分子可進入凝膠中絕大部分孔洞,在柱中受到更強地滯留,更慢地被洗脫出。分離到的外泌體在電鏡下大小均一,但是需要特殊的設備,應用不普遍。2、超濾離心。由于外泌體是一個大小約幾十納米的囊狀小體,大于一般蛋白質,利用不同截留相對分子質量(MWCO)的超濾膜對樣品進行選擇性分離,便可獲得外泌體。超濾離心法簡單高效,且不影響外泌體的生物活性,是提取細胞外泌體的一種新方法。
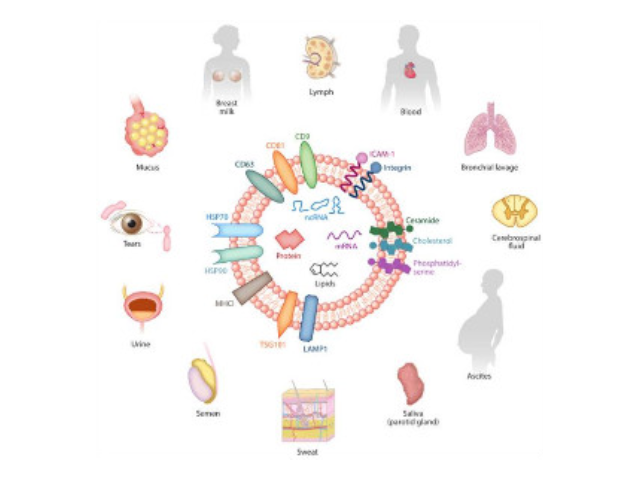
1983年,外泌體初次于綿羊網織紅細胞中被發現,1987年Johnstone將其命名為“exosome”。多種細胞在正常及病理狀態下均可分泌外泌體。其主要來源于細胞內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中。所有培養的細胞類型均可分泌外泌體,且外泌體天然存在于體液中,包括血液、唾液、尿液、腦脊液和乳汁中。有關他們分泌和攝取及其組成、“運載物”和相應功能的精確分子機制剛剛開始研究。外泌體目前被視為特異性分泌的膜泡,參與細胞間通訊,對外泌體的研究興趣日益增長,無論是研究其功能還是了解如何將其用于微創診斷的開發。如何高效地提取外泌體是實現這項新興液體活檢技術臨床常規化應用的關鍵。外泌體的提取、分離方法:超高速離心法。

為了分離外泌體,研究人員用兩個這樣的單元串聯構建了一個裝置。首先,使用聲波從血液樣品中除去細胞和血小板。一旦細胞和血小板被去除,樣品進入第二個微流體單元,然后使用較高頻率的聲波將外泌體與稍大的細胞外囊泡分開。這項工作的通訊作者之一,麻省理工學院材料科學與工程系科學家MingDao博士說:“聲波更溫和。而且在分離時,這些囊泡受處理的時間只有1秒鐘或更短。這是一個很大的優勢。”使用該設備,處理100微升未稀釋血液樣本只需要不到25分鐘。“這種新技術可以解決當前外泌體分離技術的缺點,如周期長,一致性差,產量低,污染以及完整性受損等。我們想要把提取高質量的外泌體的過程簡化為按一個按鈕就在10分鐘內獲得所需樣品一樣簡單。”研究人員們說。不同細胞分泌的外泌體具有不用的組成成分和功能,可作為疾病診斷的生物標志物。合肥外泌體提取試劑價格
外泌體提純試劑盒的特色與優勢:純化和富集的完整血漿/血清,尿液和細胞培養基中外泌體可用于功能研究。寧波外泌體提取試劑單價
功能:當外泌體在1980年初次被發現后,其被認為是細胞排泄廢物的一種方式,如今隨著大量對其生物來源、其物質構成及運輸、細胞間信號的傳導以及在體液中的分布的研究發現外泌體具有多種多樣的功能。外泌體的功能取決于其所來源的細胞類型,其可參與到機體免疫應答、抗原提呈、細胞遷移、細胞分化、一些病癥侵襲等方方面面。有研究表明一些病癥來源的外泌體參與到一些病癥細胞與基底細胞的遺傳信息的交換,從而導致大量新生血管的生成,促進了一些病癥的生長與侵襲。寧波外泌體提取試劑單價
- 鄭州正規鼠尾膠原廠家 2025-05-10
- 寧波廣州鼠尾膠原 2025-05-10
- 上海正規外泌體提取試劑報價 2025-05-10
- 無錫鼠尾膠原廠家 2025-05-10
- 合肥外泌體提取試劑廠家推薦 2025-05-10
- 鄭州正規無血清細胞凍存液哪里買 2025-05-10
- 石家莊無血清細胞凍存液報價 2025-05-10
- 蕪湖正規外泌體提取試劑哪家好 2025-05-10
- 珠海鼠尾膠原廠家現貨 2025-05-10
- 北京正規RNA提取試劑廠家現貨 2025-05-10
- 河北高純碲丸廢料加工 2025-05-10
- 中山透析袋 2025-05-10
- 廣州ms密封耐候膠供應商 2025-05-10
- 鄭州正規鼠尾膠原廠家 2025-05-10
- 附近防腐涂料生產廠家 2025-05-10
- 江西99.9%硫化鋰廠家直銷 2025-05-10
- 寧波廣州鼠尾膠原 2025-05-10
- 上海維生素k2粉末哪里有賣 2025-05-10
- 好用防腐涂料品牌 2025-05-10
- 廣州速凍庫動態冰方案提供商 2025-05-10