甘肅專注臨床前動物實驗外包
我國醫療器械臨床前安全性評價還沒有實施GLP管理,但要求開展醫療器械生物學評價試驗機構需要具備中國合格評定國家認可委員會(China National Accreditation Service for Conformity Asse ssme nt,CNAS)及中國計量認證(Chi na Metrology Accreditation,CMA)認可的實驗室資質,而對開展臨床前動物實驗研究還沒有明確的資質要求。GLP管理與CNAS認證體系雖然是兩個不同的質量管理體系,但基本內容有很多的相同性和相似性。如果參照我國相關醫療器械動物實驗研究指導原則和國家或行業標準,在具備CNAS及CMA認可資質的實驗室質量管理體系下開展醫療器械臨床前動物實驗研究,可以基本滿足臨床前動物實驗研究質量管理要求。英瀚斯專業做醫療器械臨床前動物實驗外包。甘肅專注臨床前動物實驗外包
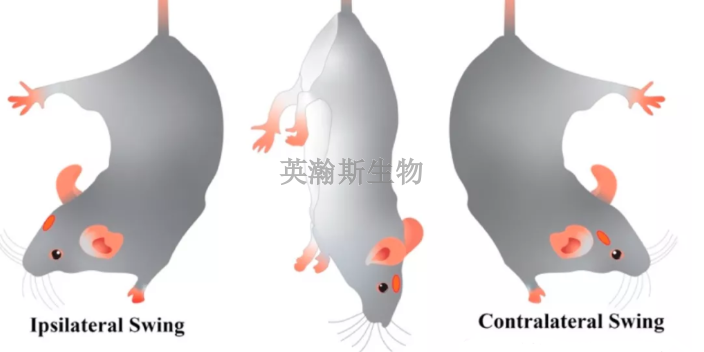
臨床前動物實驗,TGN1412是TeGenero的較早產品,從生產到進入臨床試驗才2年多時間,從MHRA批準TGN1412進入臨床試驗到試驗開始總共才45天。ESG指出,雖然臨床前動物實驗沒有發現嚴重不良反應,但不能因此估測出一個TGN1412用于人類的安全劑量,藥物的安全性未得到充分論證。實施臨床試驗的研究者沒有受到良好培訓,志愿者對可能發生的危險也了解不足。媒體和公眾都指責MHRA為了吸引醫藥公司到英國進行臨床研究而放寬了藥物臨床研究的審批。從而使一家*有15名雇員、風險資本驅動的德國小公司不在本國進行臨床試驗,卻轉而選擇英國。西藏專注臨床前動物實驗評價中成藥臨床前動物實驗公司;
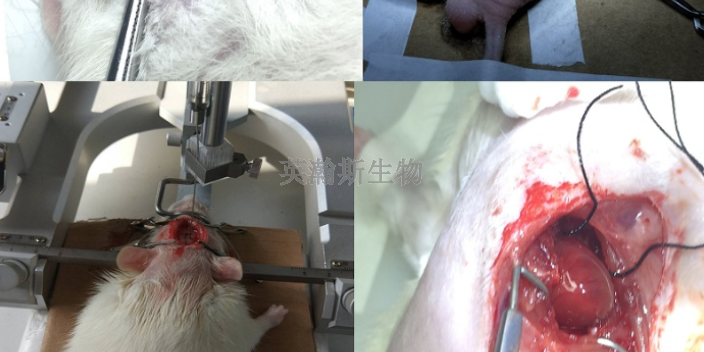
轉化型醫學試圖在基礎研究與臨床醫療之間建立更直接的聯系轉化型醫學還有更***的意義,即從患者出發開發和應用新的技術,強調的是患者的早期檢查和疾病的早期評估。從細胞水平到小動物,再到大動物乃至人體,同樣的基礎研究會產生差別巨大的結果,因此必須進行轉化研究,實現從基礎到臨床的轉化。例如研究藥物的分子靶點,首先可以在*細胞和正常細胞上進行對比研究;然后可以在小動物和大動物身上開展臨床前動物實驗。小動物的研究目前比較常用,但大動物的研究者就少了,因為大動物和小動物的***/身體體重比差別很大;另一方面,小動物的表型、基因型個體差異小,而大動物則做不到這一點,個體差異大,所以無法直接沿用小動物實驗的數據。而到臨床研究階段,從動物到人,差別就更加大,實驗就更加困難。
臨床前動物實驗由于研究的比較初目的是評價醫療器械的安全性和性能,因此,臨床前動物實驗研究的設計應帶有風險研究的目的,這些風險可以通過已知的一些因素進行預測,這些因素包括器械本身的設計、任何器械型號的已知風險和在此前的研究例如動物可行性試驗/臺架試驗、實驗室實驗/測試中可能出現的新風險等,并通過動物實驗進一步驗證和評價。建議充分考慮器械的風險分析,設計研究項目應能夠評價器械的所有風險,考慮已知的器械型號相關的任何風險。化學藥臨床前動物實驗公司;
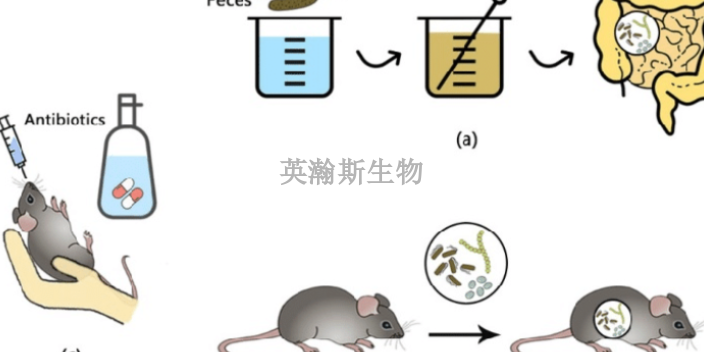
臨床前動物實驗,研究者從11名中國、意大利、瑞士、英國、西班牙等****確診患者的支氣管肺泡灌洗液中分離出了毒株,包含毒株的11個樣本***分布在所有可用基因序列構成的系統發育樹上。研究人員選擇了其中一個毒株,開發出了純化滅活的SARS-CoV-2病毒疫苗PiCoVacc。遺傳穩定性測試顯示,PiCoVacc具有出色的遺傳穩定性,不存在任何可能潛在改變NAb表位的S突變。為了生產用于動物研究的試驗規模的PiCoVacc,研究人員將其在50升Vero細胞培養物中繁殖,并使用β-丙內酯滅活。此后通過深度過濾等手段,研究團隊得到了用于實驗的高純度的PiCoVacc制劑。Science)上率先發表了疫苗的臨床前動物實驗結果。化學藥臨床前動物實驗指標;西藏專注臨床前動物實驗評價
中成藥臨床前動物實驗研究;甘肅專注臨床前動物實驗外包
臨床前動物實驗的標準操作規程以及實驗計劃和實驗方案制定:醫療器械的安全性評估通常基于所提供有效科學證據的動物實驗研究,應具有適當的標準操作規程,以確保數據的質量和完整性。研究機構應當制定與其業務相適應的標準操作規程。關于需要制定的標準操作規程可參考《藥物非臨床研究質量管理規范》第七章的合計15項條款。建議臨床前動物實驗研究包括適當的控制措施以盡量減少實驗的變異性和差錯。這樣的措施包括但不限于在試驗過程中盡量減少影響實驗動物的因素。甘肅專注臨床前動物實驗外包
- 湖北結果客觀的HE染色多少錢 2025-05-04
- 廣西病理HE染色服務 2025-05-04
- 陜西質量好的HE染色檢測 2025-05-04
- 上海靠譜的HE染色公司 2025-05-04
- 江蘇比較好的HE染色 2025-05-04
- 河北比較好的HE染色多少錢 2025-05-03
- 吉林推薦的HE染色報告 2025-05-03
- 浙江靠譜的HE染色 2025-05-03
- 廣東比較好的HE染色分析 2025-05-03
- 湖北專業的HE染色檢測 2025-05-03
- 智能醫用純水機組耗材 2025-05-04
- 浦口區預約陪診服務 2025-05-04
- 遼寧成人鼻腔沖洗液產品 2025-05-04
- 福建墊底水門汀公司 2025-05-04
- 寧波推薦艾德萊RNA提取試劑盒生產企業 2025-05-04
- 沈陽微高壓氧艙銷售 2025-05-04
- 羅湖區標準生物試劑服務熱線 2025-05-04
- 上海質量信息系統集成24小時服務 2025-05-04
- 石家莊氧艙研發 2025-05-04
- 廣東細胞灌裝系統全球安裝數量 2025-05-04